Professor Fernando Samuel Sion
Titular e Livre Docente de Clínica Médica Emérito – Alergia e Imunologia Clínica
Chefe do Laboratório de Pesquisas em Imunologia e AIDS do Hospital
Universitário Gaffrée e Guinle (HUGG)
Universidade Federal do Estado do Rio de Janeiro (UNIRIO)
O sistema imune das mucosas é altamente organizado, específico e se posiciona estrategicamente para proteger quase toda a superfície interior do corpo humano. Engloba as superfícies das mucosas da cavidade oral, da faringe, do trato gastrointestinal (GI), do trato respiratório superior e inferior, do trato urogenital, bem como as glândulas exócrinas. Apesar de determinadas diferenças em seus locais de atuação, o sistema imunológico das mucosas nos diferentes órgãos, compartilham organização anatômica e características semelhantes.
O sistema imune da mucosa gastrointestinal é composto por três compartimentos principais: uma camada epitelial, lâmina própria e do tecido linfóide associado a mucosa (MALT), que, no trato gastrointestinal, é referido como o tecido linfóide associado ao intestino. Este consiste das placas de Peyer e dos folículos linfóides isolados. O epitélio e lâmina própria são as principais frentes de batalha e, representam o local onde as respostas imunes inata e adaptativa são iniciadas (Figura 1). As células T são abundantes no sistema imune gastrointestinal. A microbiota intestinal desempenha um papel fundamental na educação e na vigilância do sistema imunológico. O delicado equilíbrio entre o crescimento microbiano e contenção é controlado pelo sistema imunitário. No entanto, esse equilíbrio é rompido em casos de infecções virais crônicas, como pelo HIV. Este vírus é capaz de alterar drasticamente o sistema imune do ambiente gastrintestinal, levando a alterações significativas da flora intestinal e da permeabilidade mucosa, resultando na translocação microbiana a partir do intestino para o sangue periférico.
As vias respiratórias com sua superfície aproximada de 70 m2 interagem constantemente com o meio ambiente através de milhares de litros de ar que são inalados diariamente. O transporte continuado partículas tóxicas, químicos, alérgenos e de microrganismos patogênicos no sistema respiratório, é um verdadeiro desafio para as barreiras físico-químicas e para o sistema imune local. Estruturas complexas foram desenvolvidas para reconhecer e impedir agressões ambientais e ao mesmo tempo permitir uma troca gasosa eficiente.
Organização do sistema linfóide das mucosas
Tecido linfóide associado às mucosas (MALT) e sua organização estratégica:
Tecido linfoide associado ao tubo digestivo (GALT – tecido linfóide associado ao intestino) um tecido altamente organizado com as placas de Peyer e apêndice, linfócitos intraepiteliais e folículos linfoides da lâmina própria (Figura 1 A). No trato respiratório o BALT – tecido linfóide associado aos brônquios e pulmões e o NALT – tecido linfóide associado ao nariz e garganta (adenoides, amidalas e o anel de Waldeyer) (Figura 1B) e NALT (tecido linfóide associado aos brônquios e cadeia do mediastino (Figura 1C) além do trato gênito-urinário, vasos linfáticos e gânglios distribuídos por todo o organismo bem como, mucosas ocular, ouvidos e glândulas exócrinas (Figura 2).
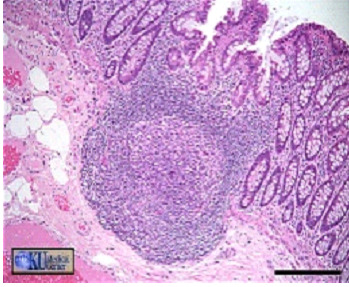
Placas de Peyer
Apêndice
Nódulos linfoides individuais

NALT:
Amígdalas
Adenoides
Anel de Waldeyer
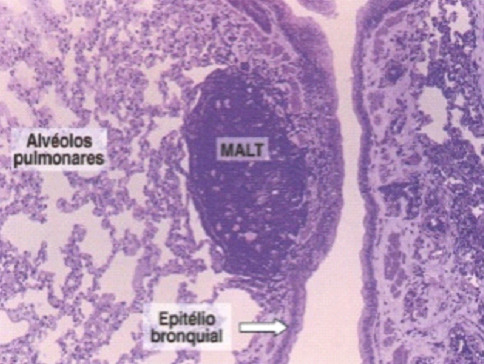
Locais de indução da resposta imune do BALT:
Linfonodos e nódulos linfáticos associados aos brônquios e mediastino
Nódulos linfoides cervicais
Nódulos linfoides individuais
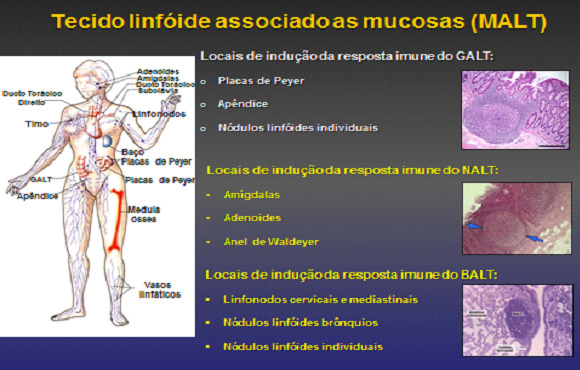
Figura 2: Resume a distribuição do tecido linfóide por todo nosso corpo.
A maioria dos linfócitos ativados nas mucosas recebem instruções para retornar ao seu local de origem na mucosa estimulada por patógenos, mas também semeiam outras mucosas com vários linfócitos T e B efetores antígeno-específica e linfócitos de memória preparados em sítios efetores nas mucosas distais. Estas já estão prontas para responder com uma resposta secundária a este patógeno quando localizadas.
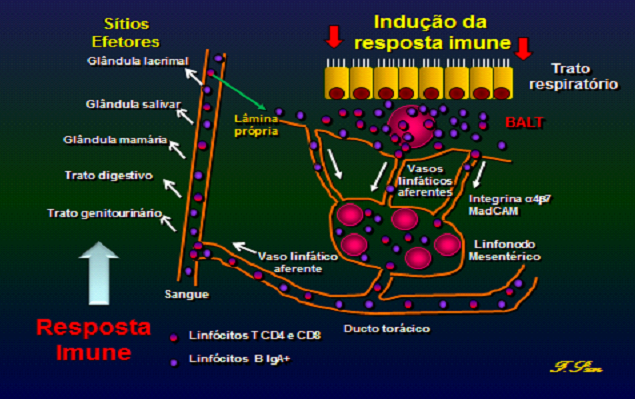
Em outros sítios no futuro. As células efetoras antígeno-específicas incluem células produtoras de imunoglobulinas, bem como linfócitos T e B maduros. A IgA secretória é a principal imunoglobulina envolvida na proteção das superfícies mucosas e é localmente produzida por células plasmáticas nos tecidos das mucosas. A este respeito, a maioria das células T e B efetoras nos tecidos linfóides são ativadas e expressam um fenótipo de memória. Assim, a resposta imune nas mucosas é iniciada no sítio indutivo, por exemplo, associado ao tecido linfóide respiratório (BALT), onde acontece o preparo e a sensibilização dos linfócitos T e B gerando células antígeno-específicas e de memória. Daí migram para os vasos linfáticos aferentes e a circulação sanguínea, alcançando outras regiões mucosas (glândulas lacrimais, mamárias, salivares, trato digestivo e gênito-urinário). (Figura 3).
O sistema imune das mucosas é sofisticado e organiza-se através de uma rede integrada de tecidos, células linfóides associadas às membranas mucosas e moléculas efetoras de anticorpos. Juntamente com citocinas, quimiocinas e seus receptores, estas moléculas efetoras, são principalmente anticorpos do isótipo IgA, sendo fundamentais responsáveis pela imunidade das mucosas e parecem funcionar em sinergia com a resposta imune inata do hospedeiro. Assim, a estimulação com antígeno, a resposta imune nestas barreiras mucosas específicas, podemos considerar um sistema imunológico comum, que apoia o conceito de distintos sítios de indução de IgA nas mucosas e nos tecidos efetores. Os tecidos linfóides associados as mucosas (BALT e MALT) servem como principais locais de indução ou de estimulação das mucosas.
O MALT é coberto por um linfoepitélio pregueado contendo células M bem como, regiões muito organizadas, um subepitélio rico em células apresentadoras de antígenos (células dendríticas), uma zona de células B com centros germinativos, e áreas de células T adjacentes, incluindo uma distribuição igual de fenótipos celulares não preparados ou naives e células T de memória. Após ativação pelo antígeno, populações de células T e B de memória, emigram a partir do ambiente indutivo da mucosa através dos tecidos de drenagem linfática, circulam através da corrente sanguínea, e interagem com as células locais efetoras nas mucosas, onde predominam uma abundante quantidade de células plasmáticas produtoras de IgA (figura 3). As células nos locais das mucosas efetoras indutoras de resposta imune incluem as células linfóides na lâmina própria do trato gastrointestinal, do trato respiratório superior, trato reprodutivo, bem como tecidos glandulares secretórios.
Principais etapas da resposta imune nas mucosasDetecção do invasor através dos receptores da imunidade inata e adaptativa. Após ativação dos receptores Toll-like, NOD-like e outros, que faz soar o alarme do sistema imune comunicando a presença de patógenos e alérgenos. Ocorre ativação do sistema de sinalização interno nas células responsáveis pela organização e a forma de como como o sistema imune deve direcionar, responder e reagir contra o agente agressor via recrutamento de moléculas adaptadoras no citoplasma que propagam os sinais até o núcleo da célula.
Quatro moléculas adaptadoras envolvidas no processo de sinalização celular são conhecidas: proteínas MyD88, Tirap, Trif e Tram. As adaptadoras ativam outras moléculas dentro da célula através do sistema das proteíno-quinases (IRAK1, IRAK4, TBK1 e IKKi) que amplificam o sinal produzindo ora estimulação ora supressão dos genes que orquestram a resposta inflamatória através da produção de citoquinas e quimiocinas.
As quimiocinas promovem quimioatração das células efetoras acessórias da resposta imune para o foco da agressão bem como a ativação das mesmas ou produzir supressão e modulação da resposta imune após o clearence do invasor.
Mecanismos operacionais da resposta imune das mucosas
Resposta imune inata ou inespecífica é necessária e fundamental para uma rápida e eficiente resposta aos patógenos e alérgenos até que a imunidade adaptativa possa começar a atuar. Resposta imune adaptativa é tardia sendo mediada pela seleção clonal e pela proliferação de linfócitos T e B específicos para um determinado tipo de agente agressor (figura 4). É capaz de gerar um alto nível de diversidade, especificidade e de construir uma memória imunológica individual. Sua principal limitação é o tempo necessário para a multiplicação e diferenciação das células imunes efetoras.

Componentes da resposta imune nas mucosas:
I – CÉLULAS EPITELIAIS:
RECEPTORES DA IMUNIDADE INATA PELAS CÉLULAS EPITELIAIS
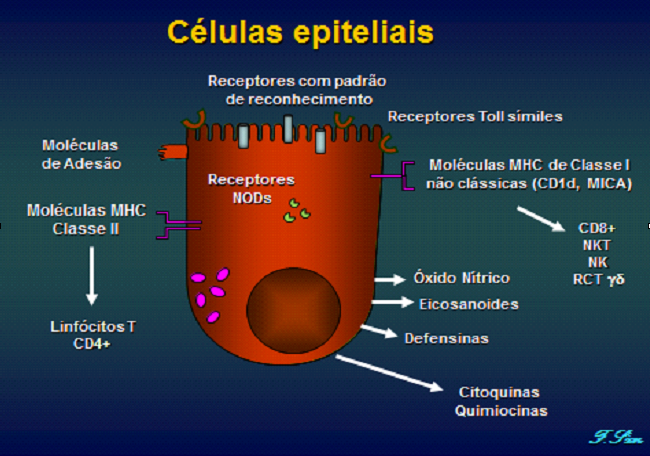
As células epiteliais se alinham na superfície das mucosas. Em conjunto com a camada de muco, geram uma barreira física entre o tecido subjacente, em grande parte estéril e o lúmen mucoso está exposto a agentes externos, é habitado por uma microbiota densa e dinâmica. As células epiteliais são estimuladas por microrganismos patogênicos adquiridos oralmente ou por via inalatória. Além disso, estas contribuem ativamente para o equilíbrio hospedeiro-microrganismos, defesa antimicrobiana e na reparação da barreira epitelial. A presença de organismos microbianos é detectada pela expressão de uma variedade de diferentes receptores imunes inatos que fazem parte da vigilância da membrana plasmática apical e basolateral, compartimentos endosomal, e pelo citosol. A barreira epitelial nas mucosas é de suma importância, pois representa a primeira linha de defesa onde podem ser identificados vários receptores Toll-like ou símiles, receptores com padrão de reconhecimento, receptores NOD-like ou NOD símiles bem como a produção de moléculas que participam da resposta imune local. (Figuras 5 e 6).
A expressão de membros da família dos tipos Toll-like ou Toll-símiles (TLR), como por exemplo, o TLR2, 3, 4, 5, e 9, os receptores internos (NOD) ou nucleotídeo de ligação e domínio de oligomerização 1 e 2, pelas helicases do ácido retinóico induzidas pelo gene (RIG-I), e pelo gene de diferenciação associados ao melanoma-5 (MDA5). Estes receptores iniciam a cascata de transdução levando os sinais do meio externo através de fatores de transcrição como o NF-kB, mitógeno proteino-quinases ativadas (MAP), interferons regulatórios (IRFs), e através da expressão do gene de influência epitelial (3/1).
Os inflamasomas, como os NOD-like estão relacionados com os receptores NLRPs NLRP3, 6, e NLRC4 ativam as caspases 1 e facilitam o processamento do pré-formado pró-IL-1β e pró-IL-18 e liberação de citocinas bioativas. A secreção de quimiocinas pelas células epiteliais sob imunoestimulação inata induzem o recrutamento de células efetoras para ajudar no combate às infecções. Consistentemente, levam a um aumento de citoquinas epiteliais e um aumento do recrutamento de granulócitos para a lâmina própria. A sinalização pelas células epiteliais também ajuda a orquestrar a resposta imune adaptativa.

Células da resposta imune inata
I – Células derivadas de linfócitos
1- Linfócitos inatos-like
⦁ Células T invariantes associadas às mucosas (MAITs)
⦁ Células T Killer naturais invariantes (iNKTs)
⦁ Células T (T )
Células B da zona marginal (MZB)
Células B-B1
2 – Células Linfoides Inatas (ILCs)
⦁ Células Natural Killer (ILCs citotóxicos)
⦁ ILCs com ácido retinóico
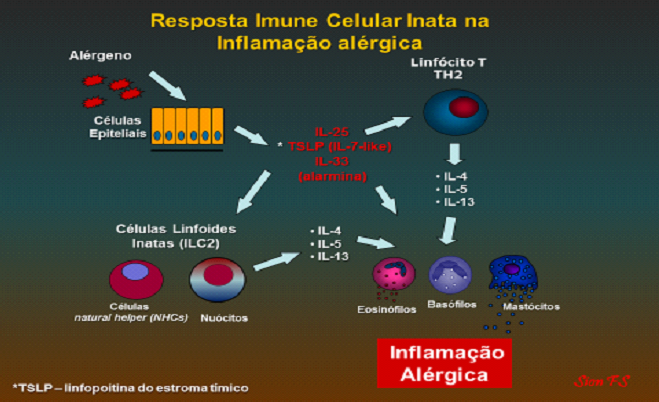
As células linfóides inatas (ILCs) tipo 2 estão presentes na lâmina própria e apresentam as seguintes características:
⦁ São incapazes de reconhecer e responder especifica e poderosamente a antígenos como as células da resposta imune adaptativa
⦁ Representam a primeira linha de defesa contra vários patógenos
⦁ Uma rápida resposta inata-like faz a ponte de ligação entre a resposta imune inata e a adaptativa
⦁ Não possuem receptores antígenos- específicos rearranjados, mas são capazes de reagir prontamente a uma grande variedade de sinais.
⦁ Têm um papel importante na homeostasia local, na formação de tecido linfóide e reparação tecidual.
3 – Células linfoides inatas (ILC2), grupo heterogêneo representado por 5 células de características fenotípicas similares (Figura 7), que dependem de cadeia γ (γc) do receptor de IL-2 e de um mediador repressor da transcrição denominado Id2 e estas são classificadas como:
⦁ Células natural helper (NHCs)
⦁ Nuócitos
⦁ Células helper inatas tipo 2 (Ih2)
⦁ Células linfoides inatas tipo2 (ILCs2)
⦁ População de células multipotentes precursoras tipo 2 (MPP tipo 2)
4 – Células acessórias da resposta imune derivadas de mielócitos e monócitos: Neutrófilos, macrófagos, eosinófilos, basófilos mastócitos e células dendríticas (Figura 7).

Células dendríticas
As superfícies mucosas contêm células dendríticas especializadas capazes de “sentir ou perceber” estímulos externos e montar ou não uma resposta imune local dependendo da natureza do antígeno (figura 9). Na ausência de patógenos, as células dendríticas da mucosa ignoram os microrganismos locais ou produzem resposta imune reguladora. Quando reconhecem patógenos que invadem a barreira mucosa, organizam uma vigorosa e eficiente resposta imune. As células dendríticas (DCs) representam o elo essencial entre a imunidade inata e adaptativa. No local da infecção, os patógenos reconhecidos pelas DCs via receptores de padrão de reconhecimento, como os receptores Toll-like (TLRs), iniciam uma resposta imune inespecífica. Dependendo da natureza do antígeno, as DCs segregam citoquinas distintas com as quais orquestram homeostase e o clearence de patógenos detonando a resposta imune inata, auxiliando e estimulando a resposta específica. A desregulação deste processo pode conduzir a inflamação desnecessária, que pode resultar numa variedade de doenças inflamatórias. Portanto, a secreção de citocinas pelas células DCs é fortemente regulada e esta regulação é facilitada por famílias de proteínas altamente conservadas. Estas proteínas reguladoras fazem o controle do transporte de vesículas a partir do Complexo de Golgi para a superfície da célula e entre as organelas. O papel dos fatores sensível de ligação de proteínas solúveis N-etilmaleimida (SNAREs) em DCs, são fatores facilitadores de secreção bem como ferramentas úteis para determinar as vias de secreção por meio de suas localizações definidas dentro das células e a especificidade de ligação nas vesículas e membranas das células alvo.
Linfócitos T e B da resposta imune específica ou adquirida nas mucosas:
⦁ Linfócitos T CD4 dos seguintes subgrupos: TH1, TH2, Th17 e Tregs (figura abaixo)
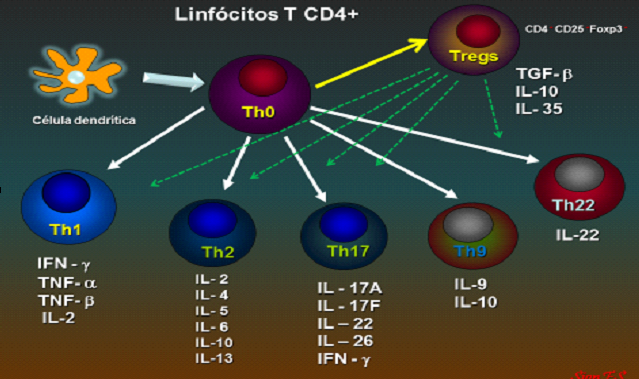
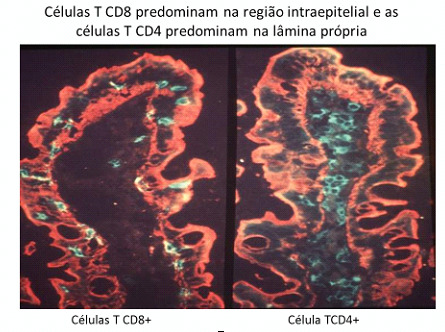
⦁ Linfócitos T CD8 intraepiteliais (LIEs): São não convencionais localizados entre as células epiteliais. A maioria dos linfócitos (80-90%) da lâmina própria expressam receptores de células T (RCT) do tipo αβ e 10-20% apresentam RCT do tipo . Ligam-se às células epiteliais através de interações com as integrinas CD103 e a caderinas do tipo E. Podem produzir (IFN-, IL-5) e ter atividade citolítica (figura 10 e 11).
Linfócitos B produtores de IgA
Linfócitos intraepiteliaisSão linfócitos TCD8+ não convencionais localizados estrategicamente entre as células epiteliais. A maioria dos linfócitos (80 a 90%) da lâmina própria expressam receptores de células T do tipo αβ e cerca de 10 a 20% dos linfócitos intraepiteliais apresentam receptores de células T do tipo . Se aderem às células epiteliais através de interações entre as moléculas de adesão, integrina CD103 e caderina do tipo E (Figura 11). Podem produzir Interferon e Interleucina 5 e possuírem atividade citolítica.
Linfócitos CD8 da lâmina própriaProduzem fatores solúveis antivirais, antibacterianos, para fungos e protozoários tais como:
⦁ Citoquinas: INF- e TNF- α
⦁ β-quimiocinas: RANTES, MIP-1α e MIP- 1β
⦁ Perfurinas e granzimas
⦁ Defensinas α 1, 2 e 3 (CAF)
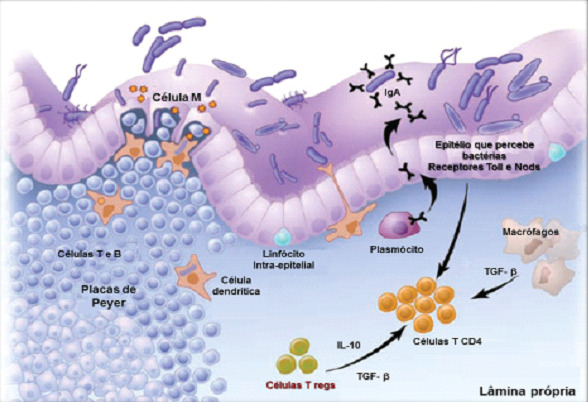
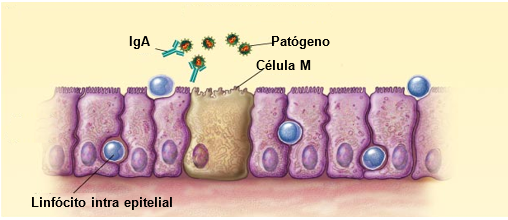
Células MO tecido linfóide associado a mucosa dos aparelhos respiratório e digestivo são recobertos por um epitélio diferenciado associado aos folículos linfóides, que inclui as células M (Figura 12) especializadas na captação e transcitose de macromoléculas e microrganismos. Após a transcitose, os antígenos são liberados para as células do sistema imune nos tecidos linfóides agregados ao longo do epitélio onde o processamento, a apresentação do antígeno, bem como, a estimulação dos linfócitos T e B ocorrem. Formam uma cesta na qual penetram linfócitos T e B. No seu interior podem ser encontradas células B “naives” e células T CD4+ do tipo TH1, TH2, TH3, TH17, T regs e células B IgA+ de memória. Logo abaixo das células M existe uma área rica em macrófagos e células dendríticas No seu interior podem ser encontradas células T e B “naives” e células T CD4+ do tipo TH1, TH2, TH3, TH17, T regs e células B IgA+ de memória. Logo abaixo das células M existe uma área rica em macrófagos e células dendríticas.
Anticorpos IgAAs superfícies epiteliais dos tratos respiratório e gastrointestinal são locais de um complexo extraordinário de interações dinâmicas. Sob pressão antigênica constante de uma vasta variedade de microorganismos, sistema imune das mucosas evoluiu mecanismos altamente sofisticados e eficazes de defesa. A produção de IgA é uma importante função efetora do sistema imune das mucosas e a IgA é o isótipo de imunoglobulina mais abundantemente produzidos no corpo humano. Os anticorpos IgA são a classe predominante no sistema imune das mucosas. É produzida pela estimulação de linfócitos B produtores de IgA sob a influência de estímulos bacterianos e virais com participação de uma citoquina denominada APRIL (Figura 13). Sua estrutura no soro é monômera e nas secreções, esta é dímera (IgAs) apresentando uma cadeia J e um componente secretório. Suas principais funções são: Inibição da ligação de patógenos às superfícies mucosas. Neutralização de bactérias e suas toxinas. Neutralização de vírus (extra e intracelulares). Absorve antígenos e fixa mal o complemento, apresentando baixo potencial inflamatório. Adaptada para o clearence de agentes infecciosos com um mínimo de destruição tecidual.
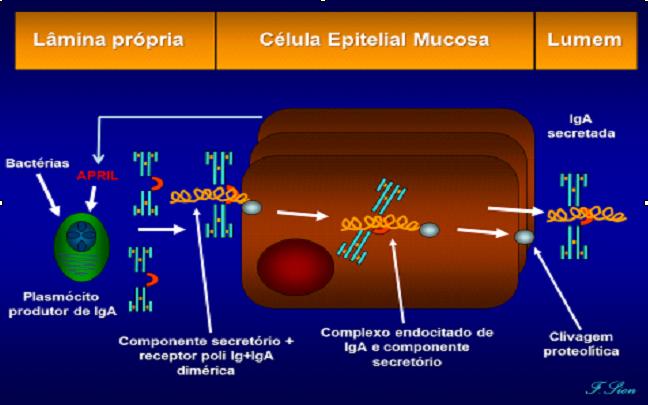
IgA dimérica é produzida na lâmina própria das mucosas e encontrada principalmente nas secreções externas. Bactérias comensais locais exercem várias funções benéficas, estimulando a produção de anticorpos IgA. IgA dimérica é ativamente transportada para secreções externas via receptor polimérico de imunoglobulinas (P Ig-R). IgA2 é mais resistente às proteases bacterianas do que IgA1. Células epiteliais liberam APRIL após percepção de bactérias através dos receptores Toll-like. Aumento na produção de APRIL por células dendríticas ativadas também é observado
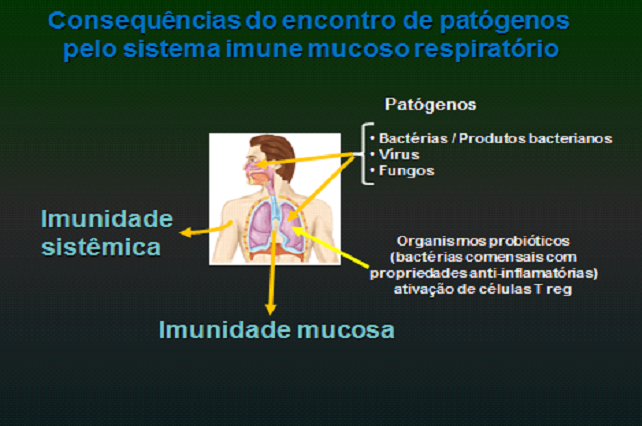
Mecanismos de resposta imune nas mucosas respiratórias e do tubo digestivo
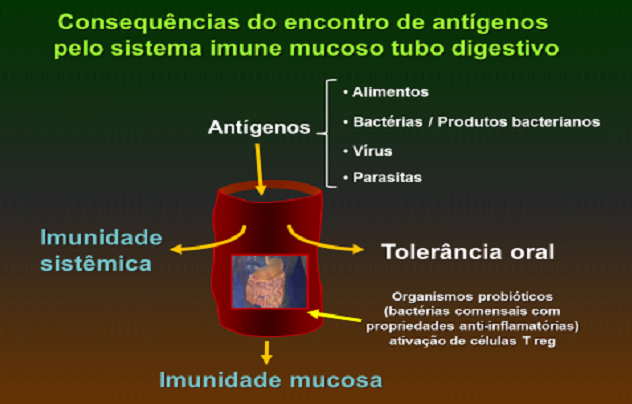
Microrganismos que penetram no trato respiratório podem gerar imunidade local nas mucosas e por via sistêmica. Os organismos probióticos dão o tom de equilíbrio da resposta imune local através da ativação das células T reguladoras que liberam mediadores anti-inflamatórios impedindo uma reação imune exagerada com consequente lesão tecidual (Figura 14).
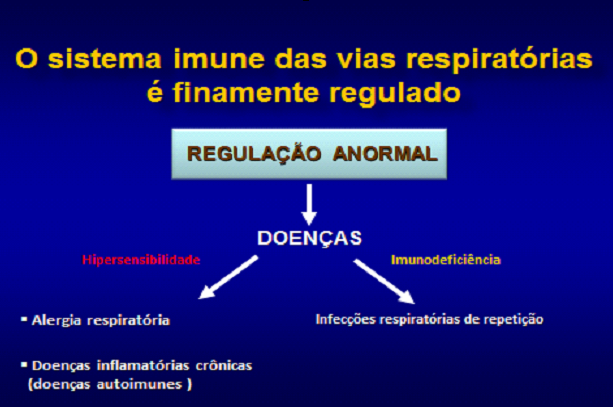
O sistema imune das mucosas é finamente regulado nas vias respiratórias. Quando este equilíbrio é quebrado e a regulação imunológica se torna anormal, indivíduos podem apresentar doenças de hipersensibilidade como a alergia respiratória (Rinite e /ou Asma alérgica) e doenças autoimunes (Lúpus Eritematoso, Esclerodermia, Síndrome de Goodpasture, etc.), assim como, doenças por imunodeficiências caracterizadas por infecções respiratórias de repetição (pneumonias, sinusites, otites, etc.) na figura 15.
Um dos principais enigmas da imunologia é o de como o sistema imune do tubo digestivo responde vigorosamente para determinados patógenos e permanece tolerante a microrganismos comensais e antígenos alimentares. Pode-se ainda arriscar em dizer que a mucosa intestinal normal, é “fisiologicamente inflamada” (Figuras 16 A e 16 B abaixo).

Figura 16A Figura 16B
O sistema imune no tubo digestivo é regulado (intensamente e equilibrado) porque se tal fato não ocorrer poderemos ter o surgimento de doenças inflamatórias, alérgicas e infecções. Esta regulação é feita pela flora comensal e pelo sistema imune local (Figura 17).
A microbiota intestinal desempenha um papel fundamental na saúde e na educação e vigilância do sistema imunológico. O delicado equilíbrio entre o crescimento e contenção microbiana nas mucosas é controlado pelo sistema imunitário. No entanto, esse equilíbrio é rompido em casos de infecções virais crônicas, como HIV. Este vírus é capaz de alterar drasticamente o sistema imunitário no ambiente gastrintestinal, levando a alterações significativas da flora e na permeabilidade da mucosa, resultando na translocação microbiana a partir do intestino para o sangue periférico. As alterações feitas localmente no intestino têm consequências de longo alcance sobre os outros órgãos a partir do fígado, onde os microrganismos e os seus produtos são normalmente filtrados, estendendo-se para o sangue e até mesmo para o cérebro.
Consequências do encontro de antígenos pelo sistema imune mucoso do tubo digestivo
O intestino humano contém mais de 100 trilhões de microrganismos. Esta microbiota desempenha um papel crucial na homeostase intestinal. E o mais importante, que a microbiota contribui para o desenvolvimento e regulação do sistema imune do intestino. O desequilíbrio da microbiota intestinal pode causar várias doenças intestinais e extra intestinais. A compreensão atual do sistema imunológico mucoso e do papel da microbiota intestinal para o desenvolvimento e funcionalidade da imunidade da mucosa, apresenta um foco particular nos tecidos linfóides associados ao intestino, na barreira mucosa, nas células TH17, nas células T reguladoras bem como nas células linfóides inatas, nas células dendríticas e nas células B produtoras de IgA. Estudos comparativos em animais de experimentação revelam que a presença da microbiota é fundamental para o desenvolvimento e regulação do sistema imune inato e adaptativo. A simbiose microbiana-hospedeiro parece ser necessária para a homeostase do intestino. No entanto, os mecanismos exatos através dos quais contribui para o desenvolvimento da microbiota e funcionalidade do sistema imunológico permanecem por ser elucidados.
Referências Bibliográficas⦁ Strober, W. Unraveling Gut Inflammation. SCIENCE. 313:1052-1054,2006
⦁ Sato, S, Kiyono, Hiroshi K. and Fujihashi, K: Mucosal Immunosenescence in the Gastrointestinal Tract: A Mini-Review. Gerontology DOI: 10.1159/000368897.
⦁ Fujihashi K, Boyaka PN, and McGhee JR: Host defenses at mucosal surfaces; in Rich RT, Fleisher TA, Shearer WT, Schroeder HW Jr, Frew AJ, Weyand CM (Eds): Clinical Immunology Principles and Practice, Ed 4. Philadelphia, Elsevier Saunders, 2013, pp 239–251.
⦁ Kiyono H, Kunisawa J, and McGhee JR, Mestecky J: The mucosal immune system; in Paul WE (Ed): Fundamental Immunology. Philadelphia, Lippincott Williams & Wilkins, 2008, pp 983–1030.
⦁ Laura E. Collins, Joseph DeCourcey, Mariana Soledad di Luca, Keith D. Rochfort and Christine E. Loscher. An emerging role for SNARE proteins in dendritic. Frontiers in Immunology | Molecular Innate Immunity March 2015 | Volume 6 | Article 133 | 1
⦁ Min YW and Rhee PL. The Role of Microbiota on the Gut Immunology. Clin Ther. 2015 Apr 3. Pii: S0149-2918(15)00146-0. Doi: 10.1016/j.clinthera.2015.03.009.
⦁ Gandhi. V.D. and Vliagoftis. H. Airway epithelium interactions with aeroallergens: role of secreted cytokines and chemokines in innate immunity. Frontiers of Immunology. 6-147:1-8. doi: 10.3389/fimmu.2015.00147
⦁ Collins et al. A role for SNAREs in dendritic cells. Frontiers of Immunology 6-133:1-6. Doi: 10.3389/fimmu.2015.00133.
⦁ Bryant, VL and Slade, C.A: Chemokines, their receptors and human disease: the good, the bad and the itchy. Immunology and Cell Biology (2015) 93, 364–371; doi:10.1038/icb.2015.23.
⦁ Wilson H L and Obradovic M R: Evidence for a common mucosal immune system in the pig. Molecular Immunology 66 (2015) 22–34. http://dx.doi.org/10.1016/j.molimm.2014.09.004.
⦁ Sonnenberg, GF. And Artis D: Innate lymphoid cell interactions with the microbiota: implications for intestinal health and disease. Immunity. October 19; 37(4): 601–610. doi:10.1016/j.immuni.2012.10.003.
⦁ Victor S Cortez, Michelle L Robinette and Marco Colonna. Innate lymphoid cells: new insights into function and development. Current Opinion in Immunology 2015, 32:71–77 http://dx.doi.org/10.1016/j.coi.2015.01.004.
⦁ Ushered, R., Klenerman, P. and Willberg, CB: Mucosal-associated invariant T-cells: new players in anti-bacterial immunity. Frontiers of Immunology. October 2014 | Volume 5 | Article 450 | 1. Doi: 10.3389/fimmu.2014.00450.
⦁ Forsythe, P: Probiotics and Lung Immune Responses. Ann Am Thorac Soc Vol 11, Supplement 1, pp S33–S37, Jan 2014. DOI: 10.1513/Annals ATS.201306-156MG.
⦁ Mowat, AM and Agace, WW: Regional specialization within the intestinal immune system. Nature Reviews Immunology. 14:667-685, 2014. Doi: 10.1038/nri3738.
⦁ Schmitt, N and Ueno, H: Regulation of human helper T cell subset differentiation by cytokines. http://dx.doi.org/10.1016/j.coi.2015.03.007.
⦁ Xiong, N and HU, S, H: Regulation of intestinal IgA responses. Cell. Mol. Life Sci. DOI 10.1007/s00018-015-1892-4.
⦁ Magri, G and Cerutti, A: Role of group 3 innate lymphoid cells in antibody production. Current Opinion in Immunology 2015, 33:36–42. Current Opinion in Immunology 2015, 33:36–42. http://dx.doi.org/10.1016/j.coi.2015.01.008
⦁ Lamichhanea, A; Azegamia, T and Hiroshi, K: The mucosal immune system for vaccine development.Vaccine.32(2014)6711–6723. http://dx.doi.org/10.1016/j.vaccine.2014.08.089
⦁ Wu Rui-Qing et al: The mucosal immune system in the oral cavity—an orchestra of T cell diversity. International Journal of Oral Science (2014)6,125–132. doi:10.1038/ijos.2014.48.
⦁ Holt, PG, Strickland, DH, Wikströmand, ME and Jahnsen, FL: Regulation of immunological homeostasis in the respiratory tract. Nature Reviews in Immunology 8:142-152, 2008. Doi: 10.1038/nri2236.
⦁ Hammad, H and Lambrecht, BN: Dendritic cells and epithelial cells: linking innate and adaptive immunity in asthma. Nature Reviews Immunology.8:193-204, 2008. Doi: 10.1038/nri2275. Immunology and Cell Biology advance online publication, 7 August 2007; Doi:10.1038/sj.icb.7100104.
⦁ Phipps, S. et al: The contribution of toll-like receptors to the pathogenesis of asthma. Immunology and Cell Biology advance online publication, August 2007; doi:10.1038/sj.icb.7100104.
⦁ Gon, Y.: Toll-Like Receptors and Airway Inflammation. Allergology International. 2008; 57:33-37. DOI: 10.2332 allergolint.R-07-157.
⦁ Kunisawa J, Nochi, T and Kiyono, H: Immunological commonalities and distinctions between airway and digestive immunity. Cell 12:505-5013. doi:10.1016/j.it.2008.07.008 Available online October 2008.
⦁ Hirosako, S. et al: Human bronchial intraepithelial T cells produce interferon-g and stimulate epithelial cells. Clinical and Experimental Immunology.155:266–274 doi:10.1111/j.1365-2249.2008.03811.x.
⦁ Aujla, S. J. and Kolls, J. K.: IL-22: A critical mediator in mucosal host defense. Mol Med (2009) 87:451–454 DOI 10.1007/s00109-009-0448-1.
⦁ Mucida, D. and Ardakani, S.S: Regulation of TH17 cells in the mucosal surfaces. J Allergy Clin Immunol 2009; 123:997-1003. doi:10.1016/j.jaci.2009.03.016.
⦁ Ma, C.S, et al: The origins, function, and regulation of T follicular helper cells. J. Exp. Med. 2012 Vol. 209: 7 1241-1253. http://creativecommons.org/licenses/by-nc-sa/3.0/.
⦁ Min YW and Rhee PL. The Role of Microbiota on the Gut Immunology. Clin Ther. 2015 Apr 3. Pii: S0149-2918(15)00146-0. Doi: 10.1016/j.clinthera.2015.03.009.
⦁ Schmitt N and Ueno H.: Regulation of human helper T cell subset differentiation by cytokines. Curr Opin Immunol.2015 Apr; 34:130-136. Doi: 10.1016/j.coi.2015.03.007.
⦁ Li P, Spolski R, Liao W, Leonard WJ.: Complex interactions of transcription factors in mediating cytokine biology in T cells. Immunol Rev. 2014 Sep; 261(1):141-56. Doi: 10.1111/imr.12199.
⦁ Scadding G.: Cytokine profiles in allergic rhinitis. Curr Allergy Asthma Rep. 2014 May; 14(5):435. Doi: 10.1007/s11882-014-0435-7.
⦁ Huber M, Lohoff M.: IRF4 at the crossroads of effector T-cell fate decision. Eur J Immunol. 2014, Jul; 44(7):1886-95. Doi: 10.1002/eji.201344279.
⦁ Lefranc¸ L. and Puddington, L.: Intestinal and Pulmonary Mucosal T Cells: Local Heroes Fight to Maintain the Status Quo. Annu. Rev. Immunol. 2006. 24:681–704 doi:10.1146/annurev.immunol.24.021605.090650.
⦁ He, B. et al Intestinal Bacteria Trigger T Cell-Independent Immunoglobulin A2 Class Switching by Inducing Epithelial-Cell Secretion of the Cytokine APRIL Immunity 26, 812–826, June 2007. DOI 10.1016/j.immuni.2007.04.014.
⦁ Fagarasan, S. and Honjo, T.: Regulation of IgA synthesis at mucosal surfaces. Current Opinion in Immunology 2004, 16:277–283. DOI 10.1016/j.coi.2004.03.005.
⦁ Gao Y and Williams AP Role of innate T cells in anti-bacterial immunity. Front. Immunol. 6:302. (2015) doi: 10.3389/fimmu.2015.00302.
⦁ Schleimer, RP et al. Epithelium: At the interface of innate and adaptive immune responses. J Allergy Clin Immunol.120 (6) 1279:1284, 2007. doi: 10.1016/j.jaci.2007.08.046